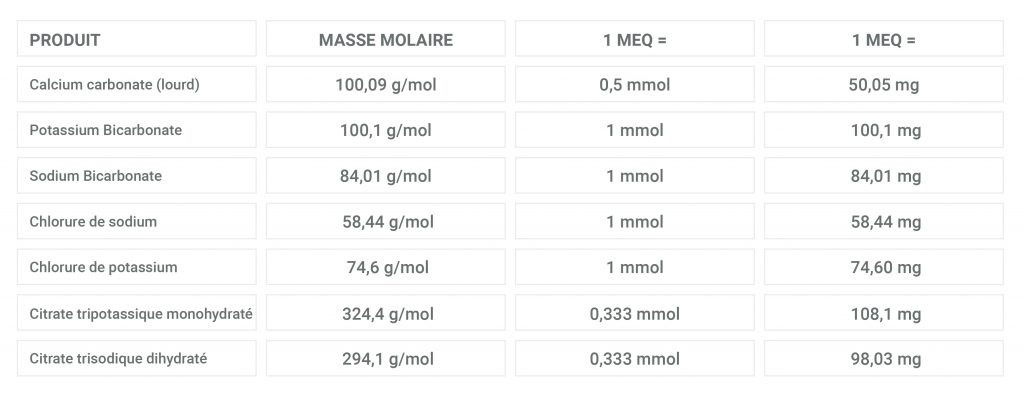
Miliequivalentes y milimoles: El miliequivalente (mEq), la milésima parte de un equivalente, se utiliza con frecuencia para expresar cantidades de electrolitos. Sin embargo, miliequivalentes y milimoles no son iguales y prescribir electrolitos en miliequivalentes puede ser una fuente de error.
Por definición, los miliequivalentes sólo se aplican a iones en solución. No es apropiado expresar en miliequivalentes una molécula entera eléctricamente neutra (por ejemplo, el citrato tripotásico).
Iones monovalentes (Na + , K + , Cl - ): 1 mmol = 1 mEq
Iones divalentes (Ca 2+ , Mg 2+ , So4 2- ): 1 mmol = 2 mEq
Ionestrivalentes (PO4 3- , C 6 H 5 O 7 3- ): 1 mmol = 3 mEq
1 mmol de molécula AB equivale a 1 mEq de A + y 1 mEq de B -
1 mmol de molécula A 2 B equivale a 2 mEq de A + (2 iones A +) y 2 mEq de B 2- (1 ion pero divalente)
1 mmol de molécula A 3 B 2 equivale a 6 mEq de A 2+ (3 iones divalentes) y 6 mEq de B 3- (2 iones trivalentes)
Fórmula general de cálculo:
1mEq = (número de mmoles para 1 mEq) x (MM de la molécula) mg
= [1 / (valencia del ion x número de átomos)] x (MM de la molécula) mg
=[MM de la molécula / (valencia del ion x número de átomos de este ion en la molécula)] mg
Se pueden utilizar varios tipos de excipientes para elaborar preparados magistrales.
Los más comunes son los siguientes:
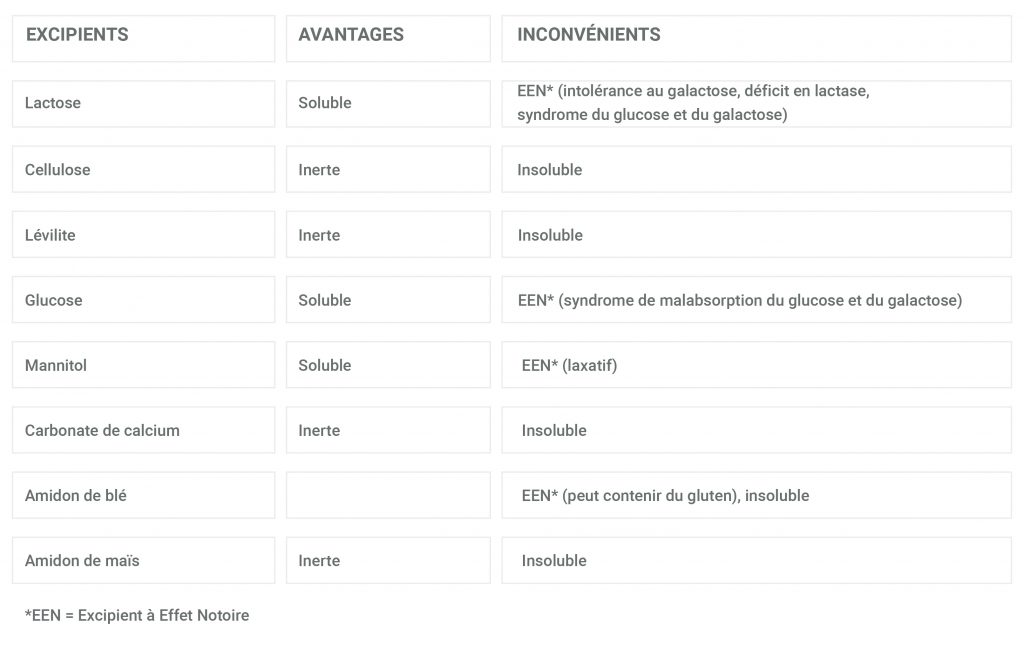
No existe un excipiente "ideal":
- La mayoría de los excipientes inertes son insolubles en agua, pero su contenido puede mezclarse con los alimentos.
- Tenga en cuenta que la mayoría de los excipientes solubles en agua tienen un efecto notorio.
| Galleta | Duración | Descripción |
|---|---|---|
| cookielawinfo-checkbox-analytics | 11 meses | Esta cookie es establecida por el plugin GDPR Cookie Consent. La cookie se utiliza para almacenar el consentimiento del usuario para las cookies de la categoría "Analytics". |
| cookielawinfo-checkbox-functional | 11 meses | La cookie se establece por el consentimiento de cookies GDPR para registrar el consentimiento del usuario para las cookies en la categoría "Funcional". |
| cookielawinfo-checkbox-necessary | 11 meses | Esta cookie es establecida por el plugin GDPR Cookie Consent. Las cookies se utilizan para almacenar el consentimiento del usuario para las cookies en la categoría "Necesario". |
| cookielawinfo-checkbox-others | 11 meses | Esta cookie es establecida por el plugin GDPR Cookie Consent. La cookie se utiliza para almacenar el consentimiento del usuario para las cookies de la categoría "Otros". |
| cookielawinfo-checkbox-performance | 11 meses | Esta cookie es establecida por el plugin GDPR Cookie Consent. La cookie se utiliza para almacenar el consentimiento del usuario para las cookies de la categoría "Rendimiento". |
| viewed_cookie_policy | 11 meses | La cookie es establecida por el plugin GDPR Cookie Consent y se utiliza para almacenar si el usuario ha consentido o no el uso de cookies. No almacena ningún dato personal. |