Milliéquivalents et millimoles : Le milliéquivalent (mEq), un millième d’Equivalent, est fréquemment utilisé pour exprimer les quantités d’électrolytes. Milliéquivalents et millimoles ne sont pas égaux et la prescription d’électrolytes en milliéquivalents peut être source d’erreurs.
Le milliéquivalent, par définition, ne s’applique qu’à des ions en solution. Il n’est pas pertinent d’exprimer en milliéquivalent une molécule entière, électriquement neutre (ex : citrate tripotassique).
Ions monovalents (Na + , K + , Cl – ) : 1 mmol = 1 mEq
Ions divalents (Ca 2+ , Mg 2+ , So4 2- ) : 1 mmol = 2 mEq
Ions trivalents (PO4 3- , C 6 H 5 O 7 3- ) : 1 mmol = 3 mEq
1 mmol de molécule AB équivaut à 1 mEq de A + et à 1 mEq de B –
1 mmol de molécule A 2 B équivaut à 2 mEq de A + (2 ions A + ) et 2 mEq de B 2- (1 seul ion mais divalent)
1 mmol de molécule A 3 B 2 équivaut à 6 mEq de A 2+ (3 ions divalents) et 6 mEq de B 3- (2 ions trivalents)
Formule générale de calcul :
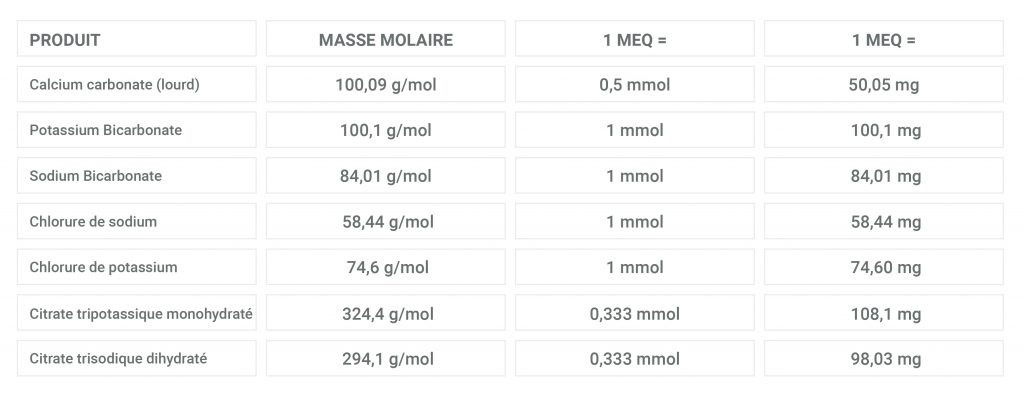
1 mEq = (nombre de mmoles pour 1 mEq) x (MM de la molécule) mg
= [1 / (valence de l’ion x nombre d’atomes)] x (MM de la molécule) mg
= [MM de la molécule / (valence de l’ion x nombre d’atomes de cet ion dans la molécule)] mg
Différents types d’excipients peuvent être utilisés pour réaliser les préparations magistrales.
Les plus courants sont les suivants :
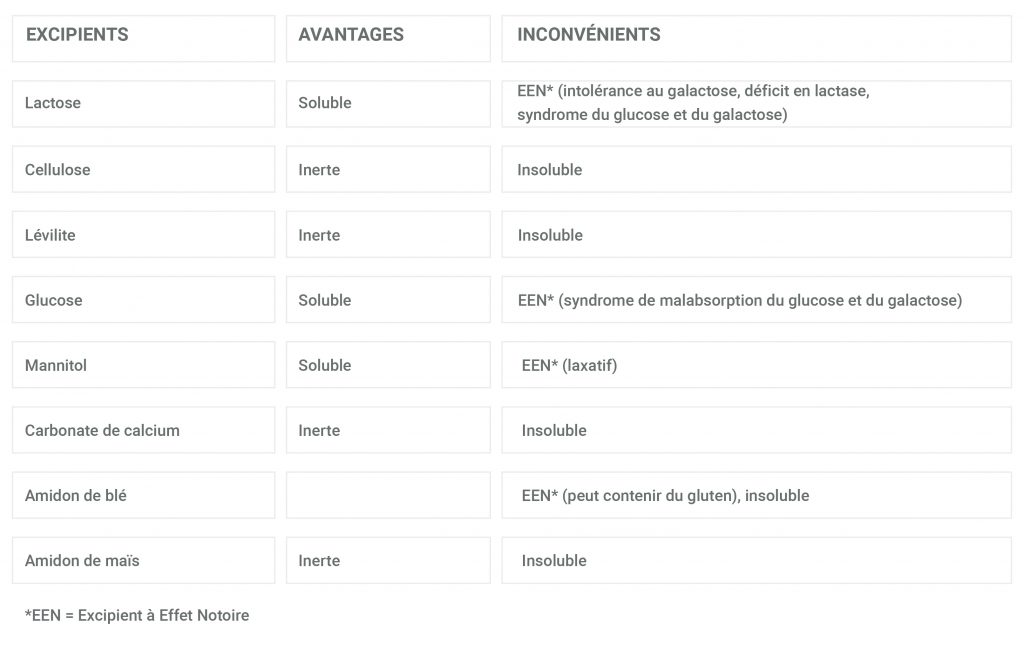
Il n’existe pas d’excipient « idéal » :
– La plupart des excipients inertes sont insolubles dans l’eau mais leur contenu peut être mélangé à de la nourriture.
– A noter, la majorité des excipients solubles dans l’eau sont à effet notoire.
| Cookie | Durée | Description |
|---|---|---|
| cookielawinfo-checkbox-analytics | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Analytics". |
| cookielawinfo-checkbox-functional | 11 months | The cookie is set by GDPR cookie consent to record the user consent for the cookies in the category "Functional". |
| cookielawinfo-checkbox-necessary | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookies is used to store the user consent for the cookies in the category "Necessary". |
| cookielawinfo-checkbox-others | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Other. |
| cookielawinfo-checkbox-performance | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Performance". |
| viewed_cookie_policy | 11 months | The cookie is set by the GDPR Cookie Consent plugin and is used to store whether or not user has consented to the use of cookies. It does not store any personal data. |